Anoda: Zn (s) → Zn2+ (aq) + 2e–
Katoda: Cu2+ (aq) + 2e– → Cu (s)
Sel Volta: Pengertian, Contoh Susunan, dan Penerapan Sehari-hari

Anak IPA kelas 12 pasti gak asing dengan sel volta pada materi elektrokimia. Jika kamu belum mendapatkan materi ini, jangan khawatir, nanti pasti melewatinya, kok.
Sembari menunggu atau mengulang materi, yuk, baca rangkuman tentang sel volta di IDN Times! Mulai dari pengertian hingga contoh, semuanya ada di ulasan ini. Cek cek, yuk!
Apa itu sel volta?
Sel volta merupakan sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik. Munculnya energi ini berasal dari pergerakan elektron karena reaksi redoks spontan, yakni oksidasi reduksi.
Selain sel Volta, sel ini juga dinamakan sel Galvani. Penyebutan tersebut berdasar pada dua orang pencetus dan pengembangnya, yakni Luigi Galvani (1737-1798) dan Alessandro Volta (1745-1827).
Galvani merupakan ahli fisiologi Italia dengan idenya membuktikan sifat listrik pada tulang hewan melalui percobaan pada tulang katak. Ide Galvani tersebut direspons oleh Volta, seorang ahli fisiologi Italia, yang menyatakan listrik ada karena kontak logam yang gak sama.
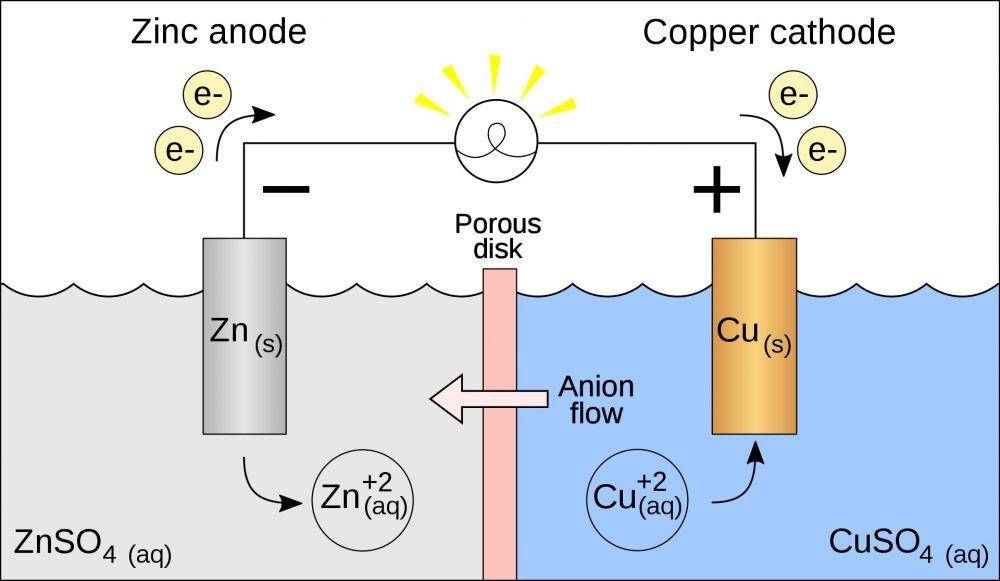
Sebagai ilustrasi, sel volta terdiri atas dua setengah sel yang terhubung dengan jembatan garam. Adapun setengah sel yang ada terdiri dari elektroda (logam) dan elektrolitnya.
Jembatan garam yang ada bukan tanpa tujuan. Adanya penghubung ini digunakan untuk menyeimbangkan muatan antar sel yang terbuat dari pipa berisi gel elektrolit.
Selain itu, ada pengukur voltase yang digambarkan dengan garis hitam. Komponen ini berfungsi guna menentukan besar dari potensi energi.
Contoh susunan sel volta
Contoh susunan sel volta bisa dilihat dari sel yang menggunakan logam Zn dan Cu. Ketika rangkaian tersusun, kedua logam tersebut dapat bereaksi secara spontan. Hasilnya, perubahan energi kimia menjadi energi listrik terjadi.
Prosesnya terjadi dengan logam Zn teroksidasi menjadi Zn2+, sedangkan sel Cu terjadi reduksi Cu2+ menjadi Cu. Pada akhirnya, pemakaian sel volta dari massa logam Zn akan berkurang sedangkan logam Cu terus bertambah.
Jika diilustrasikan, reaksi kimia yang terjadi yakni:
Reaksi volta yang terjadi menjadi Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s). Pada gambar di atas , kamu bisa melihat elektroda negatif sebagai tempat terjadinya reaksi oksidasi. Di sisi sampingnya, elektroda positif bertindak sebagai wadah terjadinya reduksi.
Lebih jelasnya proses terjadinya listrik dari sel volta sebagai berikut:
Anoda
- Mengalami oksidasi
- Melepas elektron
- Bermuatan negatif
Katoda
- Mengalami reduksi
- Menerima elektron
- Bermuatan positif
Sel volta di kehidupan nyata
Pemanfaatan sel volta juga terjadi di kehidupan sehari-hari, lho! Beberapa catu daya yang digunakan menggunakan prinsip sel volta.
1. Akumulator (AKI)
Digunakan pada banyak barang sehari-hari, seperti kendaraan bermotor. Akumulator digunakan, karena sifatnya yang murah dan bisa digunakan berkali-kali atau diisi ulang.
Sel volta pada akumulator menggunakan timbal (Pb) sebagai anoda, timbal oksida (PbO2) sebagai katoda, dan asam sulfat (H2SO4) sebagai elektrolit. Adapun reaksi yang terjadi dalam akumulator yaitu:
- Anoda: Pb (s) + SO42- (aq) → PbSO4 (s) + 2e–
- Katoda: PbSO4 (s) + 4H+ (aq) + SO42- (aq) + 2e– → PbSO4 (aq) + 2H2O (l)
2. Baterai lithium (Li)

Barang sehari-hari yang kamu gunakan ternyata menggunakan inovasi sel volta, lho! Bisa tebak? Yup, baterai ponsel sebagian besar menggunakan lithium-ion. Reaksi sel volta dinotasikan dengan:
Li|Li+|KOH (pasta)|MnO2,Mn(OH)3,C
3. Fuell cell
Fuell cell merupakan cadangan energi masa depan yang ramah lingkungan. Cara kerjanya mirip dengan baterai, tetapi reaktan yang terkonsumsi bisa diisi ulang sehingga bisa digunakan berkali-kali.
Penggunaan gas oksigen dan hidrogen yang bereaksi redoks pun menghasilkan energi listrik cukup tinggi. Reaksi yang terjadi yakni:
- Anoda: H2 (g) + 2OH– (aq) → 2H2O (l) + 2e–
- Katoda: O2 (g) + 2H2O (l) + 4e– → 4OH– (aq)
- Reaksi sel: O2 (g) + 2H2 (g) → 2H2O (l)
Ternyata sel volta sangat dekat dan berada di sekitar kita, ya? Meski gak disadari, proses elektrokimia ini sangat berguna untuk membantu aktivitas sehari-hari.